La tabla periódica es mucho más que una herramienta de referencia para los químicos. Si revisamos de cerca su evolución, encontraremos que los nombres, los símbolos, las posiciones de los elementos e incluso la forma de esta tabla ha cambiado de varias maneras con el paso del tiempo. En este artículo repasaremos desde cuando la humanidad comenzó a descubrir y comprender cada elemento de la tabla periódica.
Descubrimiento de los elementos
Durante nuestra prehistoria, los seres humanos probablemente conocían al menos tres elementos: cobre, carbono y azufre. La plata y el oro probablemente se convirtieron en parte de la vida humana alrededor del año 5000 a. C. Alrededor del año 3000 a. C., el uso generalizado del hierro marcó el comienzo de lo que llamamos la «Edad del Hierro«. Posteriormente, a estos elementos se unieron el estaño, luego el antimonio, luego el mercurio y luego el plomo, completando quizás una docena de elementos que se conocían hacia el año 1000 a. C.
Pasarían más de dos mil años antes de que se desarrollara la comprensión generalizada de elementos adicionales. El zinc, por ejemplo, había sido observado por los antiguos romanos. Pero solo alrededor del año 1100 d. C. comenzó a refinarse el zinc en la India. De manera similar, los compuestos de arsénico se observaron en los minerales de cobre durante miles de años antes del descubrimiento absoluto del arsénico elemental que generalmente se atribuye a un alquimista medieval alrededor de 1250.

En la década de 1400, el bismuto de metal pesado se notó como distinto del plomo, justo a tiempo para ser aleado con plomo para hacer tipografía de metal fundidos para la imprenta. El fósforo fue descubierto en 1669 por un alquimista que pensó que había encontrado la «piedra filosofal» para convertir otros elementos en oro. Pero fue solo en la década de 1700 que la búsqueda moderna de lo que ahora reconocemos como elementos realmente comenzó, ¡y despegó!
Para 1776, el número de elementos conocidos (23) era el doble de lo que había sido en el mundo antiguo. Para 1800, los elementos conocidos (33) ya triplicaban el número conocido en la antigüedad. En 1870, cuando apareció la primera tabla periódica, teníamos más de cinco docenas de elementos (62). Y a principios del siglo XX, teníamos casi siete docenas de elementos en la mano (83). Para 1950, se habían descubierto todos los elementos naturales. Y en las décadas más recientes, los humanos han creado veinte elementos adicionales que nunca se han encontrado en la naturaleza.
Primera versión de la tabla periódica
Cuando en 1871 Dmitri Mendeleev creó por primera vez la tabla periódica, la disposición de los elementos era lo más parecido a lo que hoy conocemos como un calendario, donde las filas representan las semanas y las columnas los días de la semana.

En la tabla periódica de Mendeléyev, las filas se denominan «períodos» y las columnas se denominan «grupos» numeradas de I a VIII en correlación con el estado de oxidación del elemento. También hizo predicciones detalladas de las propiedades de los elementos que ya había señalado que faltaban, pero deberían existir. Estas lagunas se llenaron posteriormente cuando los químicos descubrieron elementos naturales adicionales.

A diferencia de la tabla periódica moderna, las tablas periódicas de Mendeleev de hace más de un siglo tenían períodos casi uniformes del mismo tamaño, lo que hacía que pareciera más rectangular que la versión actual de la tabla.
Sin embargo, a medida que los científicos continuaron aprendiendo más sobre los elementos (de qué están hechos, cómo están estructurados los átomos y qué les da sus propiedades únicas), la composición de la tabla evolucionó hacia la forma familiar y más compleja que conocemos hoy.
La tabla periódica moderna
La tabla periódica de la actualidad, es un mapa de la estructura atómica. A medida que los átomos se vuelven más y más grandes, dichos átomos tienen más capas de subestructura. Representar esta estructura atómica tan compleja crea la necesidad de sumar columnas de elementos para mantener la periodicidad en la tabla.
Los cuatro bloques que vemos en la tabla moderna nos dan un mapa de cómo están estructurados todos los átomos. Esta es la razón por la que las filas superiores, que contienen los elementos más pequeños y simples, tienen menos miembros que las filas inferiores.

De hecho, las filas sexta y séptima de la tabla periódica contienen tantos elementos con estructuras atómicas tan complejas, que ni siquiera podemos acomodarlos todos de una sola vez. Aquí, normalmente vemos dos series de elementos fuera de línea, debajo del resto de la tabla.
Piense en cómo aparecen Alaska y Hawái en muchos mapas de los Estados Unidos, a menudo en cuadros separados en la parte inferior. Esto es simplemente para ahorrar espacio. En realidad, poner a Alaska y Hawái en el lugar que les corresponde requiere de una visión mucho más amplia, lo que a veces puede resultar poco práctico. El mismo tipo de ahorro de espacio se usa típicamente para partes de las dos filas inferiores de la tabla periódica. Cuando colocamos todos estos elementos en su lugar correcto, queda claro que las filas 6 y 7 en realidad tienen 32 elementos por período.
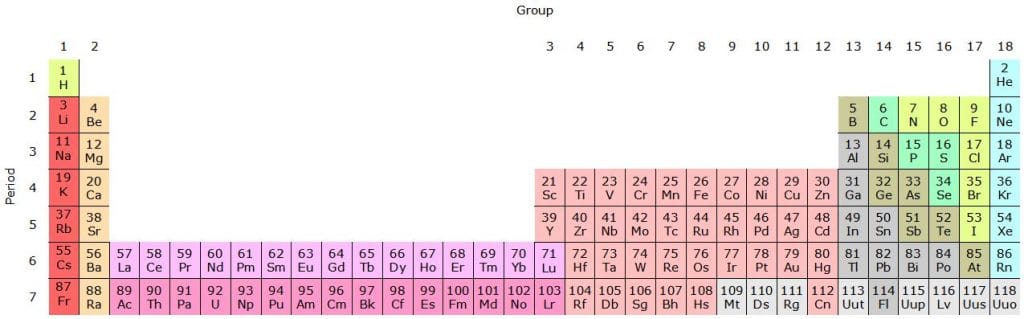
Un mapa bien organizado
La tabla periódica es un mapa de ruta de los elementos, agrupando aquellos con propiedades similares muy cerca unos de otros. Por ejemplo, los «Metales» comienzan en el extremo izquierdo y se extienden más allá del centro. Los metales de acuñación clásica, el cobre, la plata y el oro son todos vecinos en la tabla. También lo son los metales pesados notoriamente tóxicos, el mercurio, el talio y el plomo. Los «no metales» se clasifican juntos a la derecha.
A medida que nos movemos de los metales a los no metales, encontramos elementos con propiedades intermedias, como «metales débiles» y «metaloides». Los elementos radiactivos torio, uranio y plutonio que ayudaron a marcar el comienzo de la era nuclear están colocados uno cerca del otro en una sola fila muy larga de elementos completamente radiactivos en la parte inferior de la tabla.
Agrupaciones como estas nos ayudan a determinar qué elementos pueden ser útiles para un propósito determinado. Nos permite hacer todo tipo de predicciones sobre la materia, incluso sobre sustancias aún por descubrir. Es un mapa asombrosamente bien organizado para toda la materia ordinaria que conforma nuestro universo.
Fuentes:







